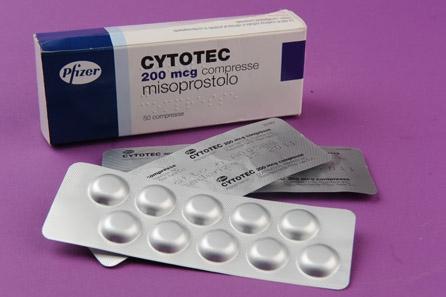
Europarlamentarul PD-L Oana Antonescu a cerut Comisiei Europene să clarifice autorizarea şi utilizarea Cytotec, după ce Jurnalul Naţional a publicat o anchetă despre moartea unei tinere şi a copilului ei nenăscut la Maternitatea din Galaţi, în urma administrării acestui medicament, care nu era autorizat.
Antonescu a anunţat ieri că a cerut Comisiei Europene să clarifice situaţia autorizării şi utilizării produsului Cytotec, cu substanţa activă misoprostol, pe tot cuprinsul statelor membre, pentru a elucida circumstanţele în care a fost utilizat acest medicament în România. Oana Antonescu, care este membră a Comisiei de Mediu, Sănătate Publică şi Siguranţă Alimentară a Parlamentului European, a sesizat CE referitor la problema accesului unor furnizori la medicamente care nu sunt autorizate la nivel european sau sunt autorizate doar într-un alt stat membru. "Medicamentul în cauză, Cytotec, nu deţinea autorizaţie de punere pe piaţă în România şi, potrivit unor informaţii de presă, nici în Uniunea Europeană", spune Oana Antonescu în sesizarea adresată CE. De asemenea, Antonescu a cerut opinia CE asupra situaţiei în care un medicament este autorizat la nivel naţional într-un stat membru, dar nu este autorizat la nivel european, precum şi a procedurilor care controlează activitatea furnizorilor de medicamente şi servicii medicale într-o asemenea situaţie.
Precizăm că informaţiile Jurnalului Naţional nu erau doar simple informaţii de presă, ci erau precizări ale Agenţiei Naţionale a Medicamentului (ANM). Chiar ieri, chestionat de noi, vicepreşedintele ANM, dr farmacist Robert Ancuceanu, ne-a confirmat faptul că ambele substanţe - Cytotec şi misoprostol care formează o unitate - nu sunt autorizate.
O SINGURĂ FORMĂ AUTORIZATĂ
"Cytotec nu este autorizat nici la noi, nici de Agenţia Europeană a Medicamentului, prin procedura centralizată care acoperă toate statele membre ale Uniunii Europene plus celelalte două state din spaţiul economic european. Medicamentul este autorizat însă de unele state, la nivel naţional, cum ar fi Marea Britanie, dar pentru tratamentul ulcerului. Iar substanţa activă a medicamentului - misoprostolul - apare doar adiacent în autorizarea EMEA emisă pentru medicamentul Misegyn. În informaţiile oficiale despre produsul Misegyn, care au fost armonizate la nivelul EMEA printr-o procedură de arbitraj, se menţionează că mifepristona, care este substanţa activă a Misegyn, poate fi folosită pentru inducerea avortului în asociere cu misoprostol. Iar în România, Misegyn este autorizat, dar nu s-a plătit taxa de menţinere în vigoare, ceea ce, în principiu, înseamnă că nu se găseşte pe piaţă. La noi în ţară există o singură formă de misoprostol autorizat, în combinaţie cu diclofenac în componenţa medicamentului Arthrotec 75, pentru protecţia mucoasei gastrice. Este ilegal să comercializezi un medicament neautorizat. ANM descurajează comercializarea produselor farmaceutice dincolo de limitele legii. Recomandăm consumatorilor să nu cumpere medicamente decât din spaţiul sigur al farmaciilor", ne-a declarat ieri vicepreşedintele ANM, dr Robert Ancuceanu.
EMEA CONFIRMĂ
"Cytotecul nu este autorizat de Agenţia Europeană a Medicamentelor şi nu se află nici în indexul aşa-numitei «Proceduri de recunoaştere reciprocă», un sistem prin care o ţară-membră a Uniunii Europene poate aproba un medicament legalizat în alt stat-membru", ne-a declarat Monika Benstetter, de la biroul de presă al agenţiei sus-amintite. Benstetter a ţinut să precizeze că răspunsurile la întrebările noastre se găsesc numai la autorităţile române şi la companiile producătoare de Cytotec. În ceea ce priveşte misoprostolul, substanţa activă din Cytotec, aceasta este autorizată în Uniunea Europeană în componenţa unor medicamente care induc avortul, ne-a mai spus Monika Benstetter. Ea a insistat însă că rezolvarea scandalului stă numai în puterea autorităţilor de resort de la Bucureşti.
Citește pe Antena3.ro