Comitetul pentru medicamente de uz uman (CHMP) din cadrul EMA, instituția responsabilă de evaluarea medicamentelor din UE, se reunește, la finalul fiecărei luni, pentru a decide dacă recomandă sau nu emiterea de autorizații pentru medicamentele care au încheiat procesul de evaluare. Chiar dacă decizia de autorizare pentru punerea pe piață aparține Comisiei Europene, aceasta urmează de regulă recomandările experților EMA.
Potrivit unei informări a Agenției Europene a Medicamentului, în ultima reuniune, care a avut loc în perioada 24-27 iunie, experții din cadrul CHMP au recomandat aprobarea pentru punere pe piața UE a 10 medicamente, printre care se regăsesc și două medicamente generice și un biosimilar, și extinderea indicației terapeutice pentru alte 11 tratamente.
Primul tratament non-injectabil pentru urgențele în alergii
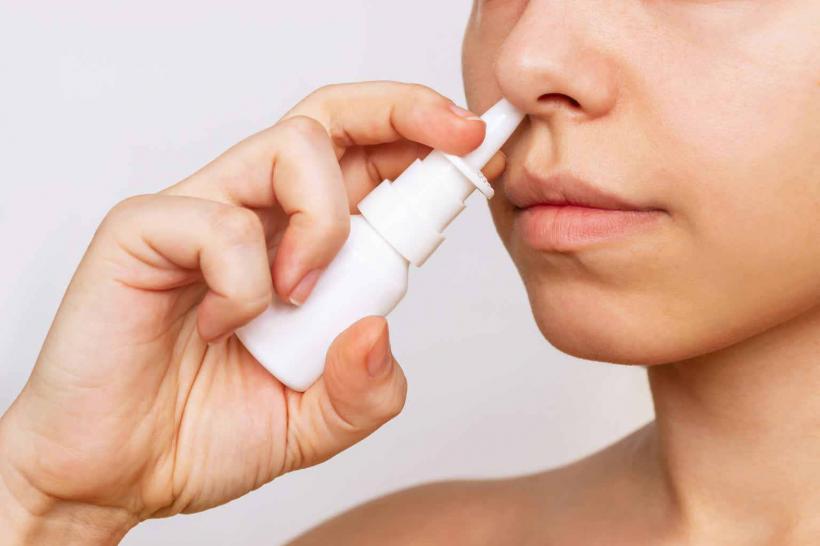
Unul dintre cele zece medicamente noi care au primit undă verde este Eurneffy (epinefrină), primul tratament de urgență în cazul reacțiilor alergice severe (anafilaxie), care se administrează cu ajutorul unui spray nazal și nu ca injecție.
Specialiștii CHMP au decis că Eurneffy ar trebui să primească o autorizație de introducere pe piață pentru anafilaxie și anafilaxie idiopatică (independentă de alte boli ale organismului – n.r.) sau indusă de efort.
Alergia este cea mai răspândită afecțiune cronică din Europa, cu 150 de milioane de europeni afectați, în 2015, iar circa 20% dintre cei care suferă de afecțiuni alergice severe trăiesc în fiecare zi cu frica unui șoc anafilactic.
Potrivit EMA, anafilaxia este cea mai severă formă de reacție alergică, care apare adesea în câteva minute de la expunerea la un alergen, de obicei din alimente, medicamente sau înțepături de insecte. Orice întârziere în diagnostic și tratament poate duce la obstrucția căilor respiratorii sau colapsul cardiovascular, care poate fi fatal.
Tratamentul cu epinefrină, cunoscută și sub numele de adrenalină, scade reacția anafilactică diminuând lărgirea și permeabilitatea vaselor de sânge induse de histamină (o substanță din organism care provoacă simptome alergice) în timpul anafilaxiei. Adrenalina relaxează, de asemenea, mușchii netezi din plămâni. Acest lucru duce la îmbunătățirea fluxului sanguin și la o respirație mai ușoară.
Deși autoinjectoarele cu adrenalină sunt foarte eficiente ca tratament de urgență, atunci când sunt utilizate în mod corespunzător, CHMP a explicat că unii pacienți și îngrijitorii lor întârzie sau nu reușesc să administreze tratamentul injectabil, fie pentru că le este frică de ac, fie că au convingerea că este nevoie de pregătire medicală pentru a face o injecție sau pentru că dispozitivul nu este accesibil.
Conform CHMP, studiile au demonstrat că spray-ul nazal de adrenalină este absorbit rapid de mucoasa nazală și distribuit în organism, cu efecte comparabile cu cele ale produselor administrate prin injecție intramusculară.
Primul vaccin anti-RSV bazat pe tehnologia ARN mesager
O altă premieră este mResvia, un vaccin ARNm pentru virusul sincițial respirator (RSV), unul dintre cele trei virusuri care, în ultimele ierni, au adus sistemele sanitare din Europa în pragul colapsului.
Deși s-au făcut cercetări vreme de șase decenii, până în vara anului trecut, oamenii de știință n-au reușit să facă niciun vaccin eficient împotriva RSV, un virus extrem de contagios care cauzează infecții ale plămânilor și provoacă zeci de mii de decese, la nivel global, în fiecare an.
Primul vaccin (Abrysvo) pentru a preveni bolile tractul respirator provocate de RSV, în special la sugari și vârstnici, a fost pus pe piața europeană cu aproximativ un an în urmă, iar acum experții EMA au dat aviz pozitiv pentru vaccinul mResvia pentru prevenirea bolilor tractului respirator inferior și a bolilor respiratorii acute cauzate de virusul respirator sincițial, la adulții cu vârsta de 60 de ani și peste.
Acesta este primul vaccin bazat pe tehnologia ARN mesager care vizează alt agent patogen decât virusul SARS-CoV-2.
Terapie mai eficientă pentru hipertensiunea pulmonară
Experții EMA au recomandat, de asemenea, acordarea unei autorizații de punere pe piață în UE pentru Winrevair (sotatercept) pentru a trata pacienții adulți cu hipertensiune arterială pulmonară, în combinație cu alte terapii specifice, pentru a îmbunătăți capacitatea de efort, precizând că acest nou medicament are potențialul de a „aduce un avantaj terapeutic major față de terapiile existente”.
Hipertensiunea arterială pulmonară este o afecțiune rară, pe termen lung, debilitantă și care pune viața în pericol, din cauza tensiunii arteriale anormal de mare în arterele plămânilor. Mulți pacienți au dificultăți de respirație care le limitează activitatea fizică. În ciuda terapiilor aprobate până acum pentru această boală, prognosticul pe termen lung rămâne prost: se estimează că aproximativ 50% dintre pacienți mor în cinci până la șapte ani de la diagnostic.
Winrevair (sotatercept) este prima terapie cu inhibitori de semnalizare a activinei aprobată pentru tratarea HAP. Practic, sotatercept reglează creșterea de noi celule ale vaselor de sânge în plămâni. Acest lucru duce la reducerea îngustării și îngroșării vaselor de sânge, îmbunătățind astfel simptomele bolii.
Tratamente noi în UE și pentru afecțiunile oncologice
Totodată, în cadrul reuniunii CHMP din luna iunie, a fost recomandată autorizarea următoarelor medicamente:
- Balversa (erdafitinib), pentru tratamentul adulților cu carcinom urotelial nerezecabil sau metastatic, un cancer al vezicii urinare și al sistemului urinar.
- Ordspono (odronextamab), autorizație condiționată, pentru tratamentul pacienților cu limfom folicular și limfom difuz cu celule B mari, două tipuri de cancer de sânge care afectează sistemul imunitar.
- Piasky (crovalimab), pentru tratamentul pacienților cu hemoglobinurie paroxistică nocturnă, o afecțiune hematologică genetică rară care provoacă descompunerea prematură a celulelor roșii din sânge de către sistemul imunitar și care poate pune viața în pericol.
- Tauvid (flortaucipir), pentru tomografia cu emisie de pozitroni (PET) a creierului la pacienții adulți cu tulburări cognitive care sunt evaluați pentru boala Alzheimer.
- Steqeyma (ustekinumab), un medicament biosimilar pentru tratamentul pacienților adulți cu boala Crohn moderată până la severă, psoriazis în plăci și artrită psoriazică.
- Enzalutamide Viatris (enzalutamidă), medicament generic, pentru cancer de prostată.
- Nilotinib Accord (nilotinib), medicament generic, pentru tratamentul pacienților cu leucemie mieloide cronice cu cromozom Philadelphia pozitiv.
Pe lângă acestea, specialiștii CHMP au avizat pozitiv actualizarea compoziției vaccinului Comirnaty, pentru a ținti noua subvariantă JN.1 a virusului SARS-CoV-2.
În primele șase luni ale acestui an, EMA a recomandat autorizarea a 57 de medicamente pe piața UE și extinderea indicației terapeutice pentru 40 de medicamente existente, iar în 2023, autorizarea a 77 de medicamente și extinderea indicației pentru 77 de tratamente existente.
Românii au acces doar la unul din șase medicamente autorizate în UE
Deși numărul tratamentelor inovatoare care primesc undă verde pe piața UE este destul de mare, pacienții români au acces doar la 17% din medicamentele aprobate la nivel european în perioada 2019-2022, conform Asociaţiei Române a Producătorilor Internaţionali de Medicamente (ARPIM), care, recent, a făcut publice o serie de date cuprinse în trei rapoarte publicate în luna iunie 2024 de Federaţia Europeană a Industriilor şi Asociaţiilor Farmaceutice (EFPIA).
Conform datelor culese din 36 de ţări (27 din UE şi 9 din afara UE), din cele 167 de medicamente inovatoare care au primit aprobare din partea EMA în perioada 2019-2022, în România, la 5 ianuarie 2024 erau disponibile doar 29 de medicamente. Niciun medicament aprobat la nivel european în 2022 nu era compensat în România la data respectivă. În cazul tratamentelor oncologice, din cele 48 de medicamente noi, care au primit aprobare europeană în perioada 2019-2022, doar 9 erau disponibile în România la 5 ianuarie 2024.
În Europa, rata medie de disponibilitate a medicamentelor noi este de 43%, în topul ţărilor cu cea mai mare rată de disponibilitate situându-se: Germania (88%), Italia (77%) şi Austria (75%). Chiar și ţări vecine sau comparabile cu România se situează mult în faţa noastră - Bulgaria (43%), Polonia (41%), Ungaria (30%) - conform studiului prezentat de ARPIM.
De asemenea, timpul de acces la aceste medicamente inovatoare este cu mult mai mare pentru pacienții români.
Astfel, timpul de la aprobarea EMA până la disponibilitatea în România este de 778 de zile, adică peste 2 ani, în timp ce pacienții germani au acces la medicamente de ultimă generație în doar 126 de zile, italienii în 424, maghiarii în 650, iar bulgarii în 728 zile. În cazul medicamentelor oncologice, timpul de acces este chiar mai mare, ajungând la 828 de zile pentru pacienții români.